Halogenatioun
D'Halogenatioun ass eng cheemesch Reaktioun bei där en Halogen (z. B. Fluor, Chlor, Brom) un eng aner cheemesch Substanz addéiert gëtt.
Haliden aus Alkoholer mat Hëllef vun Triphenylphosphine-Carbon Tetrahaliden
[änneren | Quelltext änneren]Déi Reaktioune si relativ empfindlech op Fiichtegkeet.
E puer Resultater vun där Reaktioun:
| Alkohol | Kachpunkt vum Chloride | (%)Resultat vun der Ëmwandelung |
|---|---|---|
| 2-Butanol | 68 | 65 |
| 1-Butanol | 78 | 89 |
| Neopentyl Alkohol | 85 | 76 |
| 1-Decanol | 223 | 78 |
| Benzyl alcohol | 178 | 83 |
Haliden aus Alkoholen a Phenolen aus Triphenylphosphine Dihaliden
[änneren | Quelltext änneren]Déi Reaktioun geet och mat anere Léisungsmëttelle wei z. B. CH3CN ouni datt den Cyanur substituéiert gëtt. Interessant ass et och datt sou een och ka p-Chlorobromobenzene maache well den Alkohol substituéiert gëtt an net de Chlor (90% Rendement).
E puer Resultater vun dëser Reaktioun:
| Alkohol | Kachpunkt vum Chloride | (%)Resultat vun der Emwandelung |
|---|---|---|
| Isobutyl | 91 | 89 |
| Neopentyl | 109 | 79 |
| 2-Butyl | 91 | 90 |
| Cyclopentyl | 137 | 83 |
| Cyclohexyl | 165 | 88 |
| Cholesterol | (Schmëlzp. 96-98) | 80 |
Allylic a Benzylic Brominatioun mat N-Bromosuccinimide
[änneren | Quelltext änneren]N-Bromosuccinimide gëtt normalerweis mat NBS ofgekierzt
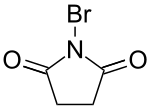
Systemateschen Noum: 1-Bromo-2,5-pyrolidinedione
NBS gëtt gebraucht fir mat engem Bromatom eng Moleküll unzegréifen. Et ass also eng Source vu Brome fir organesch Chimisten.
Beispiller
A. 3-BROMOCYCLOHEXENE
[änneren | Quelltext änneren]B. 4-BROMO-2-HEPTENE
[änneren | Quelltext änneren]
C. 1-PHENYLETHYL BROMIDE
[änneren | Quelltext änneren]Alpha-Bromination vun Ketones an Dehydrobromination
[änneren | Quelltext änneren]Allgemeng Reaktioun:
Wéi ee gesait handelt et sech em Equilibren an et kann een also och gebrauche fir ee Bromatom lasszegin.
Des Reaktioun erméiglecht Hiirstellung vun z. B. 2-BROMOCHOLESTANONE, trans-3-BROMO-trans-10-METHYL-2-DECALONE oder CHOLESTENONE
Referenzen
[änneren | Quelltext änneren]1. I. M. Downie, J. B. Holmes, and J. B. Lee, Chem. lnd. (London), p. 900 (1966).
2. J. B. Lee and I. M. Downie, Tetrahedron 23, 359 (1967).
3. A. W. Friederang and D. S. Tarbell, /. Org. Chem. 33, 3797 (1968).
4. G. A. Wiley, R. L. Hershkowitz, B. M. Rein, and B. C. Chung, /. Amer. Chem. Soc. 86,964 (1964).
5. D. Levy and R. Stevenson, J. Org. Chem. 30, 3469 (1965).
6. J. P. Schaefer, J. G. Higgins, and P. K. Shenov, Org. Syn. 48, 51 (1968).
7. C. Djerassi, Chem. Rev. 43, 271 (1948); L. Horner and E. H. Winkelmann in "Newer Methods of Preparative Organic Chemistry" (W. Foerst, ed.), Vol. 3, Academic Press, New York, 1964.
8. N. S. Isaacs, "Experiments in Physical Organic Chemistry," p. 276. Macmillan, London, 1969.
9. F. L. Greenwood and M. D. Kellert, /. Amer. Chem. Soc. 75, 4842 (1953); F. L. Greenwood,M. D. Kellert, and J. Sedlak, Org. Syn. Collective Vol. 4, 108 (1963).
10. H. J. Dauben and L. L. McCoy, /. Amer. Chem. Soc. 81, 5405 (1959).
11. H. O. House and H. W. Thompson, /. Org. Chem. 28, 360 (1963).
12. H. O. House and R. W. Bashe, /. Org. Chem. 30, 2942 (1965).
13. A. Butenandt and A. WoIfT, Chem. Ber. 68B, 2091 (1935).
14. M. Yanagita and K. Yamakawa, /. Org. Chem. 21, 500 (1956).
15. G. F. H. Green and A. G. Long, /. Chem. Soc., p. 2532 (1961).
16. E. A. Fehnel, S. Goodyear, and J. Berkowitz, /. Amer. Chem. Soc. 73, 4978 (1951).
17. E. L. Bennett and C. Niemann, /. Amer. Chem. Soc. 74, 5076 (1952).
18. D. S. Noyce, B. N. Bastian, P. T. S. Lau, R. S. Monson, and B. Weinstein, /. Org. Chem. 34, 1247 (1969).
19. R. S. Monson in "Advanced Organic Synthesis", Rhadon Academic Press, New York and London, (1971)

![{\displaystyle \phi _{3}P+CCl_{4}\rightarrow \phi _{3}P^{\oplus }{\text{---}}CCl_{3}(Cl^{\ominus })\quad {\xrightarrow[{({\text{---}}CHCl_{3})}]{R{\text{---}}OH}}\quad \phi _{3}P^{\oplus }{\text{---}}O{\text{---}}R(Cl^{\ominus })\rightarrow R{\text{---}}Cl+\phi }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6353aad4cf54e6dc27dfb74296304293a6056e0)